
- Accueil
- Conformité 21 CFR Part 11
- Dossiers de lots électroniques pour la conformité pharmaceutique numérique
Conformité 21 CFR Part 11

Dossiers de lots électroniques pour la conformité pharmaceutique numérique
Dossier de lot électronique | EBR | Dossier de fabrication par lots | BMR | Bonnes pratiques de fabrication | BPF
Ce livre blanc porte sur les enregistrements électroniques de lots (EBR) et le rôle qu'ils jouent dans la création d'un environnement de fabrication pharmaceutique entièrement numérique conforme aux 21 CFR partie 11.
Pendant de nombreuses années, les entreprises de fabrication pharmaceutique ont produit des médicaments, des médicaments et des produits thérapeutiques en grandes quantités pour contrôler l'économie du produit final. La production de lots importants permet au fabricant de garder un contrôle strict sur le processus de formulation du produit avec un contrôle sur les quantités et les processus.
Les dossiers de fabrication par lots (communément appelés EBR) ont été l'épine dorsale de la traçabilité des lots et des lots pour les sociétés pharmaceutiques pendant des décennies et ont été un élément essentiel du processus de diligence raisonnable de fabrication pour répondre aux normes réglementaires strictes.
Ce document explique les bases des processus de formulation et comment les enregistrements de lots sont utilisés par les fabricants de produits pharmaceutiques pour créer un processus de traçabilité sans papier et crédible qui résiste aux réglementations pharmaceutiques.
Qu'est-ce qu'un dossier de fabrication par lots (BMR) ?
Une fois qu'un lot a été formulé en production (souvent une combinaison d'ingrédients pesés, ensachés et en vrac), toutes les étapes devront être documentées. Un Batch Manufacturing Record (BMR) fournit la documentation qui répertorie, étape par étape, les quantités d'ingrédients ajoutées au lot. Données supplémentaires telles que les dates d'ajout, les codes de lot internes et du fournisseur, l'opérateur responsable, la date et l'heure, le lieu, etc.
Toutes les données capturées fournissent au fabricant une traçabilité des lots en plus de prouver que les bonnes pratiques de fabrication (BPF) ont été respectées. Les exigences GMP incluent les séquences de formulation, les procédures opératoires standard, les instructions de mélange et, fondamentalement, tout ce qui est pertinent pour montrer que l'opérateur a suivi un processus de fabrication par lots structuré.
Il existe une énorme variabilité dans les processus de fabrication des médicaments, qui est largement centrée sur la taille du lot de fabrication (qui doivent tous être détaillés dans un dossier de lot électronique (EBR) - voir la section ci-dessous). De nombreux fabricants s'appuient sur le pesage manuel à l'aide de petites balances de précision pour les ingrédients actifs tout en utilisant un équipement de pesage de grande capacité / un équipement de manutention en vrac contrôlé par PLC pour les ingrédients moins critiques. L'équipement utilisé au cours du processus dépend presque entièrement de la taille de lot souhaitée.
Évidemment, plus le processus de fabrication est complexe, plus le processus de tenue des dossiers de fabrication par lots devient difficile. Cette complexité a créé un besoin pour plus d'automatisation et moins de marge d'erreur dans la fabrication.
Les enregistrements manuels de fabrication par lots sont encore très courants aujourd'hui (pour démontrer les bonnes pratiques de fabrication (BPF) en plus de la traçabilité vérifiée), mais leur crédibilité peut être suspecte et coûteuse à produire - obligeant souvent les superviseurs à surveiller et à documenter un processus par lots qui est déjà en cours. enregistré par un opérateur de production par lots. Ce coût a créé une opportunité pour des enregistrements de lots entièrement électroniques, connus sous le nom d'EBR.
Qu'est-ce qu'un dossier électronique de lot (EBR) ?
Les processus de fabrication par lots peuvent être complexes, chronophages et longs. Les fabricants de produits pharmaceutiques mettent désormais en place des systèmes informatisés pour fournir des enregistrements de lots électroniques générés automatiquement, ou EBR en abrégé.
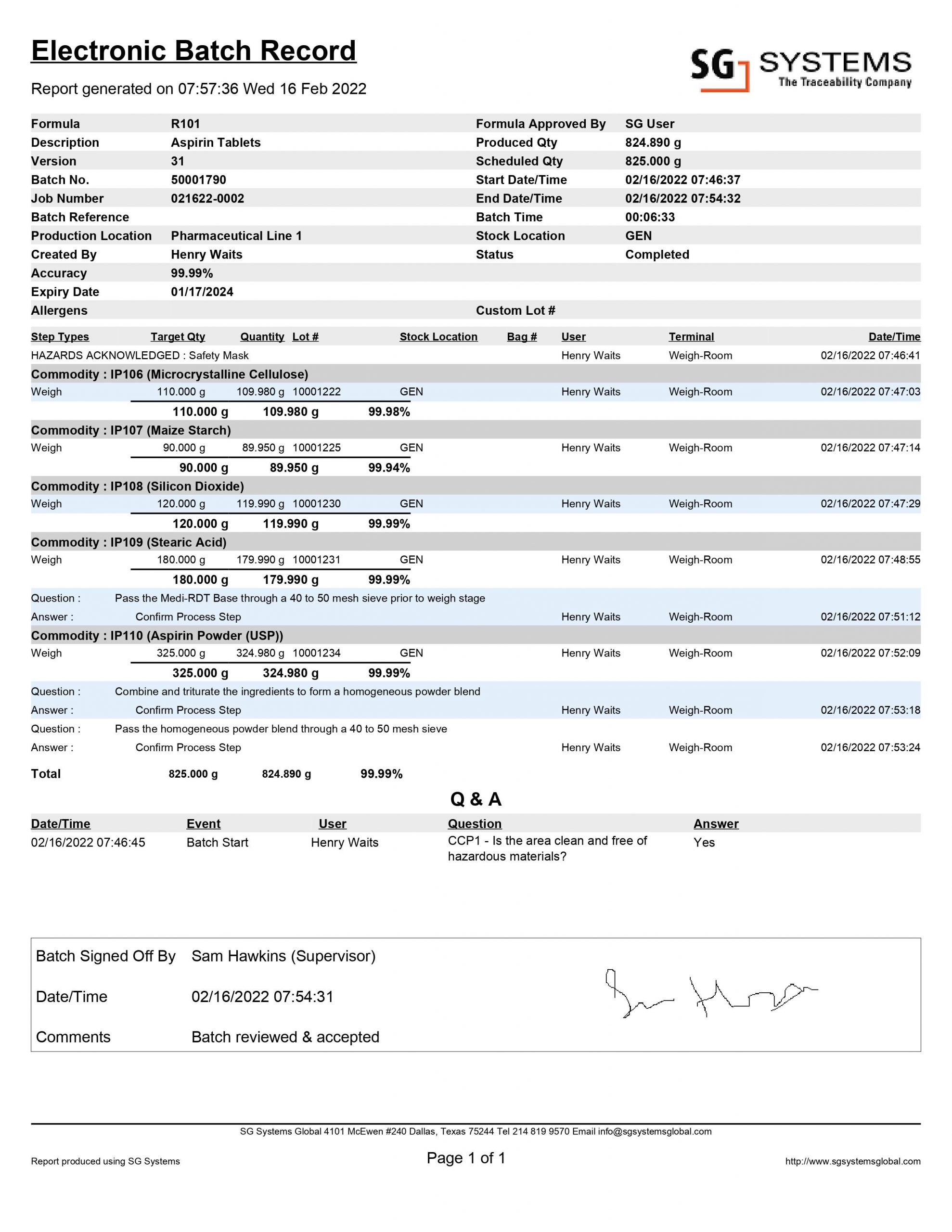
Les enregistrements de lots électroniques (voir l'exemple ci-dessus) remplacent officiellement les enregistrements manuels de fabrication de lots par une version numérique conforme à la norme 21 CFR Part 11. Les EBR peuvent extraire leurs données directement de l'équipement de fabrication (balances et équipement de pesage connectés au logiciel de formulation, lecteurs de codes-barres pour la validation des ingrédients et des lots, imprimantes d'étiquettes pour la sérialisation des lots WIP lisibles par l'homme).
Logiciel d'enregistrement électronique de lots
Contrôler les processus d'enregistrement électronique des lots avec Traçabilité V5 de SG Systems Global, aide les fabricants de toutes sortes à éliminer les erreurs humaines et à supprimer la paperasserie par lots. Les fabricants de produits pharmaceutiques peuvent tirer parti d'un système qui répond aux exigences législatives (garantissant la conformité technique avec 21 CFR Part 11) tout en améliorant la cohérence des lots et la qualité.
Conformité aux critères ALCOA + pour l'intégrité des données
V5 Electronic Batch Record EBR System est conforme aux cinq critères originaux utilisés pour l'intégrité des données basés sur l'acronyme ALCOA qui a été développé dans les années 1980 par un inspecteur de la FDA et également avec l'ALCOA + étendu à partir de 2010. Tous ces éléments contribuent au concept d'enregistrement électronique des lots. .
Voir les critères en neuf points énumérés et résumés ci-dessous :
- Attribuable Identification de la personne qui a effectué une activité et la date à laquelle elle l'a effectuée. Le temps est également applicable avec un système informatisé et un fuseau horaire si un système s'étend sur des fuseaux horaires.
- Lisible Pouvez-vous lire et comprendre les données électroniques ainsi que les métadonnées associées ou toutes les entrées écrites sur papier ? Lisible doit également s'étendre à toutes les données originales qui ont été changées ou modifiées par une personne autorisée afin que l'entrée originale ne soit pas masquée.
- Contemporain Documenté (sur papier ou électroniquement) au moment de l'activité.
- Original Une observation écrite ou un imprimé, ou une copie certifiée ou vérifiée de celui-ci, ou un enregistrement électronique comprenant toutes les métadonnées d'une activité.
- Précis Aucune erreur dans les observations originales et aucune modification sans modifications documentées/entrées de piste d'audit par le personnel autorisé. Toute instrumentation utilisée est qualifiée et calibrée selon les critères d'acceptation.
- Complète Toutes les données de l'analyse, y compris toutes les données générées avant qu'un problème ne soit observé, les données générées après la répétition d'une partie ou de la totalité du travail ou de la réanalyse effectuée. Pour les systèmes hybrides, la sortie papier doit être liée aux enregistrements électroniques sous-jacents utilisés pour la produire.
- Cohérent Tous les éléments du dossier GMP, tels que la séquence des événements, sont cohérents et ne se contredisent pas. Les entrées sont la date (tous les processus) et l'heure (parfois des enregistrements papier et tous utilisant un système hybride ou électronique) estampillées dans l'ordre prévu.
- Permanent Enregistré sur des supports autorisés, par exemple, des feuilles de travail numérotées pour lesquelles il existe une responsabilité ou des supports électroniques qui peuvent durer tout au long de la période de conservation des enregistrements.
- Disponible La collection complète d'enregistrements peut être consultée ou récupérée pour examen et audit ou inspection pendant toute la durée de vie de l'enregistrement.
Validation du système informatique
Dans le cadre de l'installation de V5 Traçabilité, SG Systems Global peut vous fournir une documentation spécifique au système pour répondre QI/QO dans un délai rapide.
FAQ sur les enregistrements électroniques de lots
Que sont les enregistrements électroniques de lots (EBR) ? Les enregistrements électroniques de lots sont des versions numériques des enregistrements manuels traditionnels de fabrication de lots utilisés dans la fabrication pharmaceutique.
Quel est le rôle de l’EBR dans la fabrication pharmaceutique ? Les EBR maintiennent la traçabilité des lots et font partie intégrante du respect des normes réglementaires.
En quoi un EBR diffère-t-il d’un dossier de fabrication par lots (BMR) traditionnel ? Un EBR automatise et rationalise le processus de documentation d’un BMR, améliorant ainsi l’efficacité et la précision.
Pourquoi l’industrie pharmaceutique a-t-elle besoin d’enregistrements électroniques de lots ? La complexité et la variabilité de la fabrication des médicaments nécessitent davantage d’automatisation et des marges d’erreur réduites, pour lesquelles les EBR sont essentielles.
Quels sont les avantages de l’utilisation des enregistrements électroniques de lots ? Les EBR aident à éliminer les erreurs humaines, à réduire la paperasse, à améliorer la cohérence des lots et à garantir la qualité.
Comment les EBR sont-ils conformes aux normes réglementaires telles que 21 CFR Part 11 ? Les systèmes EBR sont conçus pour répondre aux exigences législatives, garantissant le respect des normes telles que 21 CFR Part 11.
Qu’est-ce qu’ALCOA+ et quel est son lien avec les EBR ? ALCOA+ est un ensemble de critères d’intégrité des données auxquels se conforment les systèmes EBR.
Qu’implique la validation du système informatique pour les EBR ? La validation implique la fourniture d’une documentation traitant des qualifications d’installation et opérationnelles.
Les EBR peuvent-ils s’intégrer aux équipements de fabrication existants ? Oui, ils peuvent s’intégrer directement aux équipements existants, permettant une capture transparente des données.
Quel est l’impact des EBR sur la conformité aux BPF ? Les EBR améliorent considérablement la conformité aux bonnes pratiques de fabrication.
Comment la technologie EBR améliore-t-elle la traçabilité dans la fabrication pharmaceutique ? Il capture et stocke numériquement toutes les données pertinentes de production par lots, améliorant ainsi la traçabilité.
Les EBR sont-ils requis par les autorités réglementaires ? Bien qu’ils ne soient pas explicitement requis, ils sont fortement recommandés pour la conformité et la traçabilité.
Quels sont les défis liés à la mise en œuvre des EBR ? Les défis comprennent la garantie de la compatibilité des systèmes, la formation du personnel et le respect des normes réglementaires.
Comment la technologie EBR répond-elle à la variabilité des processus de fabrication de médicaments ? Les EBR fournissent une plate-forme flexible adaptable à différents processus et tailles de lots.
Quelles sont les perspectives d’avenir des EBR dans la fabrication pharmaceutique ? Les perspectives d’avenir sont prometteuses en raison de leur efficacité, de leurs avantages en matière de conformité et de leurs capacités d’intégration.
Les EBR peuvent-ils être personnalisés pour des besoins spécifiques en matière de fabrication pharmaceutique ? Oui, les systèmes EBR sont généralement personnalisables.
Quel type de formation est requis pour que le personnel puisse utiliser efficacement les systèmes EBR ? La formation implique généralement la compréhension de l’interface du logiciel et des exigences de conformité.
Comment les EBR garantissent-elles la sécurité et la confidentialité des données ? Les systèmes EBR utilisent des fonctionnalités de sécurité robustes pour protéger les données sensibles.
Quel impact les EBR ont-ils sur l’efficacité de la production ? Ils améliorent l'efficacité de la production en automatisant la tenue des registres et en réduisant les erreurs manuelles, essentielles aux BPF (bonnes pratiques de fabrication).
L’utilisation des EBR présente-t-elle des avantages environnementaux ? Les CDE contribuent à la durabilité environnementale en réduisant le besoin de dossiers papier.
Informations complémentaires – pour plus d'informations sur la traçabilité V5 et son dossier de lot électronique | EBR | Dossier de fabrication par lots | BMR | Bonnes pratiques de fabrication | Applications GMP, veuillez contacter www.sgsystemsglobal.com. Pour une plongée approfondie dans 21 CFR Part 11 et la validation des systèmes informatiques, veuillez visiter ici
Dernières publications
Amérique du Nord
SG Systèmes LLC
4101 McEwen # 240, Dallas TX 75244
Tel: +1 214 819 9570 XNUMX
Nous contacter ici
Royaume Uni
SG Systems Europe SA
Suite 3 Walton Summit Center, Green Place, Four Oaks Rd, Preston, PR5 8AY
Téléphone: + 44 (0) 114 349 1480
Nous contacter ici
Australie
Wedderburn
101, chemin Williamson, Ingleburn NSW 2565
Tel: +61 2 9426 1800 XNUMX
Nous contacter ici
Europe
SG Traçabilité Systèmes Ltée
31-32 Greenmount Office Park, Harolds Cross, Dublin D6, Irlande
Téléphone: + 44 (0) 114 349 1480
Nous contacter ici
Soyez assuré que nous respectons votre vie privée et nous nous engageons à protéger vos données. En cliquant sur "Continuer avec les paramètres recommandés", vous nous autorisez à utiliser des cookies. Bien sûr, vous avez le contrôle - n'hésitez pas à ajuster vos paramètres de cookies à tout moment dans nos préférences de confidentialité.
