
- 主页
- 21 CFR 第 11 部分合规性
- 药品制造合规性
21 CFR 第 11 部分合规性

药品制造合规性
但你不会注意到科学! 自从 1997 年法规允许使用带有电子批次记录的数字系统以来,503b 制药公司在采用包括制药制造监管合规软件(以获得 21 CFR Part 11 合规性)在内的系统方面仍然进展缓慢。 这是由于围绕确保数据安全、遵守内部程序和外部监管合规性的内部问题,以及历史上规避风险的行业更喜欢“如果它没有被破坏,为什么要改变它?”的方法。 那么也许食谱管理软件值得再看一眼?
这些原因也导致进入市场的新配方管理软件供应商短缺,因为人们认为“太难”证明他们可以提供可行的替代方案……直到现在。

制药制造法规遵从性软件解决方案提供商最初急于进入制药行业,但许多没有将流程步骤的简单性与合规性或与最终用户 ERP 系统的链接结合起来。 今天,客户仍然发现市场上的许多配方管理软件解决方案“擅长一件事,但不是全部”。 SG Systems 的血统书 配方系统 与客户ERP链接意味着他们已经去过那里并做到了,全球范围内有许多满意的客户。
它已集成到30多种企业资源计划(ERP)和会计软件应用程序中,以确保高级公司数据管理与工厂现场实际情况之间的无缝链接。
电子批次记录
数字批记录 (EBR)使操作变得更加动态,因为只需单击几下鼠标即可获得信息以进行检查或审核。 与仅对纸质或混合记录的审阅相比,“电子审阅”的效率要高得多。
SG Systems Global 与制药行业领先的专家合作,以确保他们的配方管理软件解决方案符合制药监管合规软件和最佳实践。

V5可追溯性在技术上符合21 CFR Part 11 (查看评估) 以及 SG Systems Global 已准备好与客户合作,以确保客户内部流程保持一致,以完全遵守法规。
SG Systems Global 客户体验的方法是使他们的系统能够执行复杂的数据管理和流程控制任务的“科学”留在后台。 优先考虑的是用户界面直观、易于使用且基于权限,因此您只能做您被允许做的事情——所有这一切意味着您可以轻松开展业务,同时确保所有重要数据正在记录合规性。
为什么要通过制造可追溯性实现数字化?
改善制造和交货时间
V5可追溯性提供了简单而又巧妙的EBR,可加快生产时间并减少交付给客户的交货时间。
质量保证(QA)团队可以使用V5的EBR的“按例外查看”功能,比查看每条记录更快地查看偏差。 这大大减少了文档审查时间,并有助于确保产品从生产到仓库后就可以立即下达。
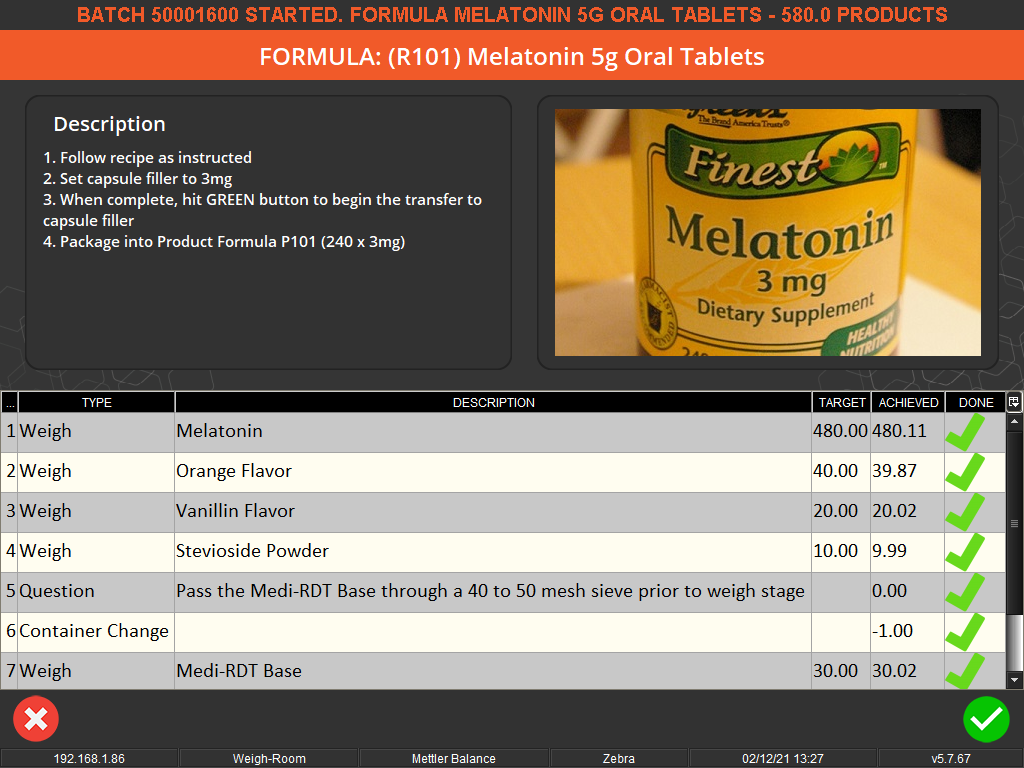
由于实时事件数据的清晰度和可用性,批次准确性和一致性也得到了提高。
生产流程和仓库管理(库存移动)也得到实时有效管理,这进一步减少了基于纸张或独立流程管理系统的任务时间。
降低制造成本的配方管理软件
节省时间可以节省成本。 V5可追溯性解决方案可确保轻松实现数字合规性,减少以前在纸质系统上花费的时间以及多个交叉检查和验证阶段。
V5可追溯性通过简单的“通过/不通过”屏幕指示来指导操作员和主管人员完成制造和验证过程,并在管理层定义的步骤中提出质量检查问题,这意味着合规性是过程的一部分,而不是过程的一部分。然后整理运动。
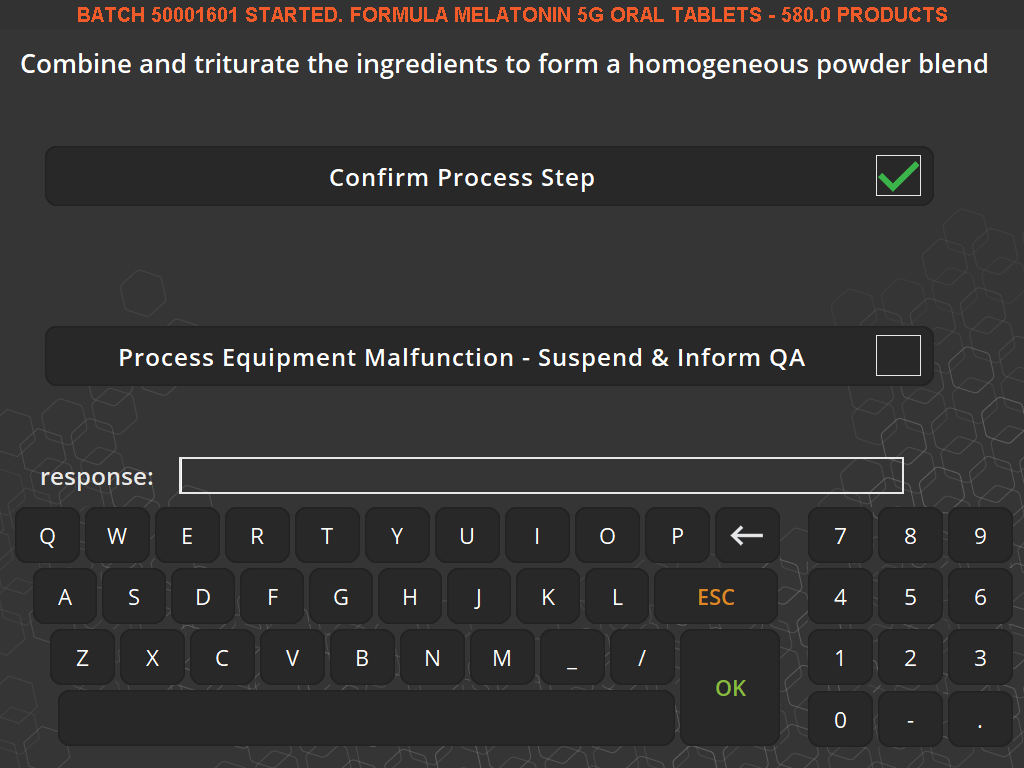
避免不良数据——消除转录错误
V5 配方管理软件减少了人为错误,因为说明在屏幕上可见,数据输入通常通过下拉选择,或者在成分类型、成品批次和批号选择的情况下,通过条形码扫描仪扫描。
与V5可追溯性的这种最小的人机交互确保了产品出现任何问题时的快速发布。
药品监管合规
无论你转向哪个方向,503b 批量称重制药领域都没有“规避”方案。 值得庆幸的是,V5 Traceability 将所有必需的检查和各种签署阶段带入了数字时代,因此合规性毫不费力。 没有人会失误,因此您大可放心,消费者或审核员不会有任何意外!
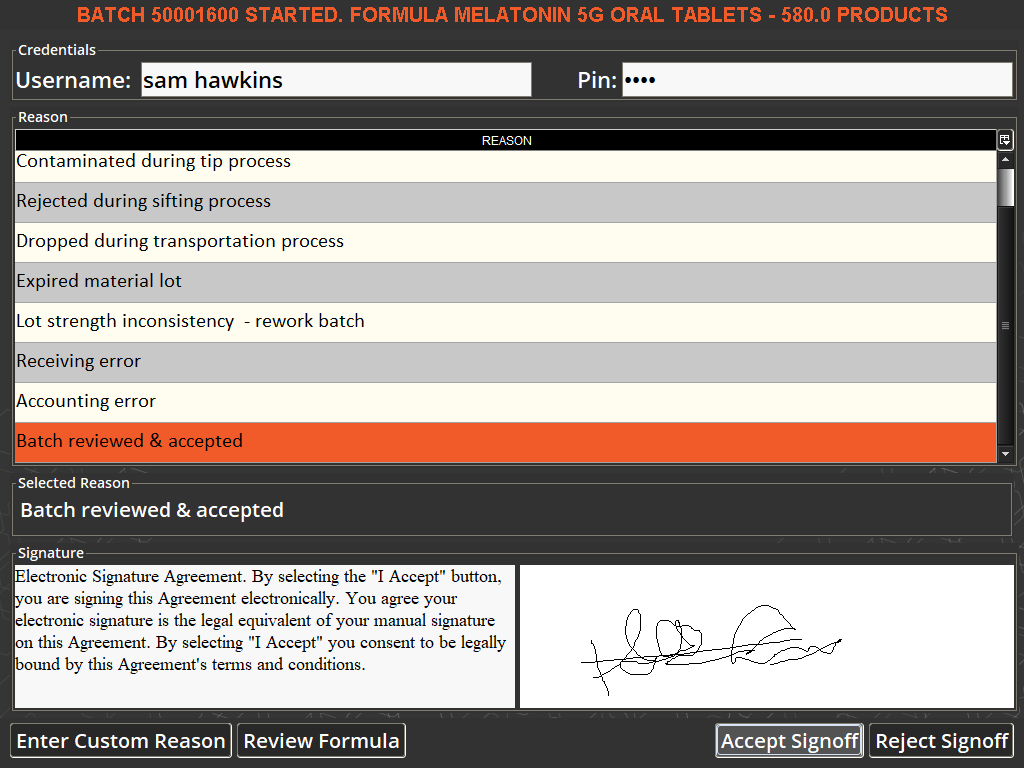
确保合规性的相同程序也意味着您自己的产品在默认情况下是一致的,这意味着客户更加满意。 同样,也获得了序列化,这是实现“无纸化”目标的又一次巨大胜利,所有数据符合要求,导致配方管理软件中的全电子批次记录。
符合ALCOA +数据完整性标准
V5 药品制造监管合规软件符合最初用于数据完整性的五项标准,这些标准基于 FDA 检查员在 1980 年代开发的首字母缩写词 ALCOA 以及从 2010 年开始扩展的 ALCOA+。请参阅下面列出的九点标准:
•归属 进行一项活动的个人的标识以及他们进行的日期。 如果系统跨越时区,则时间也适用于计算机系统和时区。
•清晰 您能否阅读和理解电子数据以及任何相关的元数据或纸上的所有书面条目? 易读还应扩展到已由授权个人更改或修改的任何原始数据,以免原始条目被遮盖。
•同期 活动时记录(以纸质或电子形式)。
• 原版的 书面观察或打印输出,或其认证或核实副本,或电子记录,包括活动的所有元数据。
•准确 未经授权人员进行文件化的修正/审核跟踪条目,原始观察结果中没有错误,也无法进行任何编辑。 所使用的任何仪器均应在合格标准内进行鉴定和校准。
•完成 分析中的所有数据,包括观察到问题之前生成的任何数据,重复执行部分或全部工作或重新分析后生成的数据。 对于混合系统,纸张输出必须链接到用于生成纸张的基础电子记录。
•一致 GMP记录的所有元素(例如事件顺序)是一致的,并且彼此不矛盾。 条目是按预期顺序标记的日期(所有过程)和时间(有时是纸质记录,并且全部使用混合动力或电子系统)。
•持久 记录在授权媒体上,例如具有责任心的编号工作表或可以在整个记录保留期内持续使用的电子媒体。
• 可用的 可以访问或检索记录的完整集合,以在记录的整个生命周期中进行检查,审核或检查。
通过网关链接或API平滑集成
V5 配方管理软件与我们易于使用的超链接 EBR 相结合,大大降低了制造和合规流程的复杂性。
V5可追溯性使用简单 网关 文件交换或API(SG系统网关链接)以将车间活动与后台管理联系起来。
与客户ERP集成后,可节省大量时间,从而可以随时随地从工厂或仓库访问关键信息。
电子配方配方系统
V5 药品制造监管合规软件控制访问权限和特权,可选择通过单点登录 (SSO) 链接到客户端安全协议——所有这些都符合 21 CFR 第 11 部分提供的电子批次记录。
配方版本是电子控制的,因此只有经批准的配方才能投入生产,从而进一步避免了错误和昂贵的废料批次。
没有机会输入不正确的数据,这使各个操作员及其管理人员确信所有步骤均已正确完成。
合格/不合格批次称量可确保生产出一致的批次且符合要求。
批复批流程
V5可追溯性EBR使用电子签名(如果需要,可在SSO下进行确认)在交易地点确认和验证批次和系统合规性信息,从而节省时间并消除与纸质系统相关的风险,因为纸质系统在生产和签收之间可能会损坏或丢失关闭地点。

总之,数字过程控制和符合 V5可追溯性 将:
- 消除纸质表格,缩短产品上市时间
- 增加产量
- 电子批记录
- 确保产品一致性,这意味着更少的废料批次和更高的客户满意度
- “无形地”遵守21 CFR Part 11,使公司管理层和审计师充满信心
- 通过节省时间和成本来提高利润
致谢
• Bob McDowall 博士 – 主任 RDMcDowall 有限公司 (1998 年至今)专注于企业计算机系统验证和 21 CFR 第 11 部分政策、数据完整性、分析设备认证以及 GMP、GLP 和 GCP 计算机化系统的验证。 对实验室、计算机化系统和软件供应商的审计。
•Darren Fisher – Fisher咨询服务有限公司董事。15年与多个行业领先的OEM一起在各个制造行业从事配方和可追溯系统的工作。
北美
SG 系统有限责任公司
4101 McEwen#240,达拉斯TX 75244
电话:+1 214 819 9570
联系我们 点击此处
英国
SG 系统欧洲有限公司
普雷斯顿四橡树路格林顿广场沃尔顿峰会中心3室,PR5 8AY
电话:+ 44(0)114 349 1480
联系我们 点击此处
澳大利亚
温德本
新南威尔士州101,英格本,2565 Williamson Road
电话:+61 2 9426 1800
联系我们 点击此处
欧洲
SG 溯源系统有限公司
31-32 Greenmount Office Park, Harolds Cross, 都柏林 D6, 爱尔兰
电话:+ 44(0)114 349 1480
联系我们 点击此处
请放心,我们重视您的隐私并致力于保护您的数据安全。 单击“继续使用推荐的设置”,即表示您授予我们使用 cookie 的权限。 当然,一切尽在您的掌控之中 – 您可以随时在我们的隐私偏好设置中调整您的 cookie 设置。